Структура атома
Деф: Атом је најситнија честица неког хемијског елемента која задржава његове хемијске особине.
Постојале су разне теорије о структури атома. Неке од њих су Томсонова,
Радерфордова...
Џ. Џ. Томосон је (1903) предложио модел атома по коме атом представља сферу у којој је равномерно распоређена позитивна количина наелектрисања, у којоj се налазе електрони. Електрони осцилујући око својих равнотежних положаја. То је такозвани модел јагоде са саменкама.
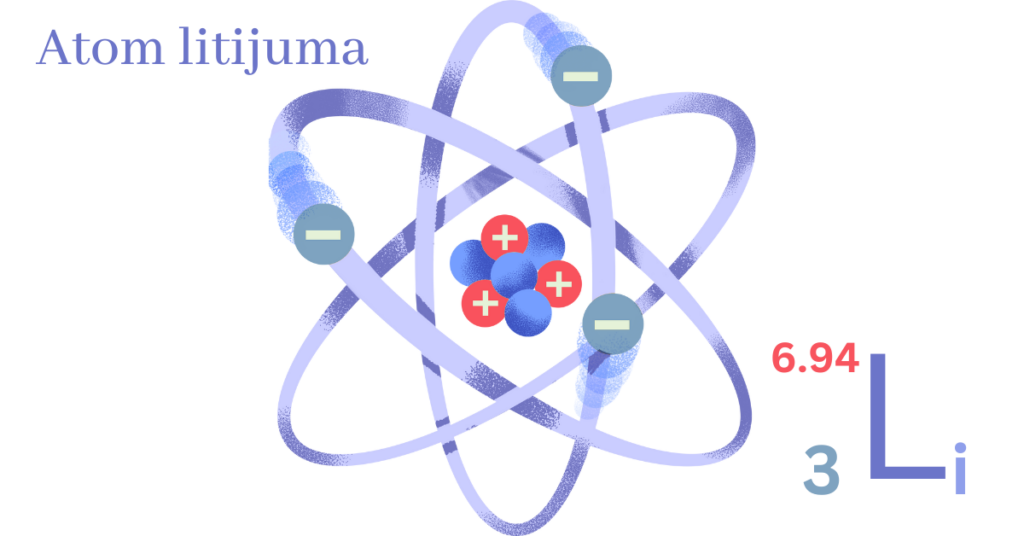
Радерфорд је (1911.) је на основу експеримената у коме је пропуштао честице кроз фолију од злата. Формулисао планетарни модел атома, користећи сличност са Сунчевим планетарним системом.

По радерфорду, атом се састоји од језгра (нуклеус) и омотача.
У језгру су честице које се заједничким именом називају нуклеони а то су: протон и неутрони.
У електронском омотачу круже електрони.
Електрони су негативни, протони су позитивни, а неутрони су неутрални тј. ненаелектрисани.
Атом је као целина неутралан (јер има исти број протона и електрона који имају исту количину наелектирсања различитог знака).
Највећи део атома је празан простор. Маса атома сконцентрисана је у језгру, а маса електрона је занемарљива.
Сваки атом одређен је са два броја:
- А-масени број ( који представља збир броја протона и неутрона)
- Z-редни ( који представља број протона и означава место у периодном систему)
Јонизацијом атом може да отпушта електроне и постаје позитиван јон или прима електроне и постаје негативан јон. Број протона и неутрона остаје исти.
Изотопи су језгра атома са истим редним али различитим масеним бројем. Најпознатији је изотоп водоника.

Нуклеарне силе
Нуклеарне силе се јављају у језгру атома, нуклеусу одатле и потиче њихов назив.
Особине нуклеарне силе су:
- То су најјаче силе до сада откривене у природи. Пуно су јаче од Кулонових , електричних сила.
- Делују између протона и неутрона.
- Делују на малим растојањима (кратког су домета).
- Делују само између суседних нуклеона.
- Не зависе од наелектрисања. Исте су између два протона, два неутрона и протона и неутрона.